研究課題
X線結晶構造解析のボトルネックとなっている結晶化の工程を省略または簡略化するさまざまな技術を開発する。

研究課題
X線結晶構造解析のボトルネックとなっている結晶化の工程を省略または簡略化するさまざまな技術を開発する。

研究内容
研究課題にて開発された技術を基盤とし、創薬・食品・香料・化学研究における新しい研究手法やアプローチを提唱・実践する。

教育内容
左記の研究を通して、学生の教育および若手教員の育成をはかる。
軸不斉と中心不斉を一挙に構築
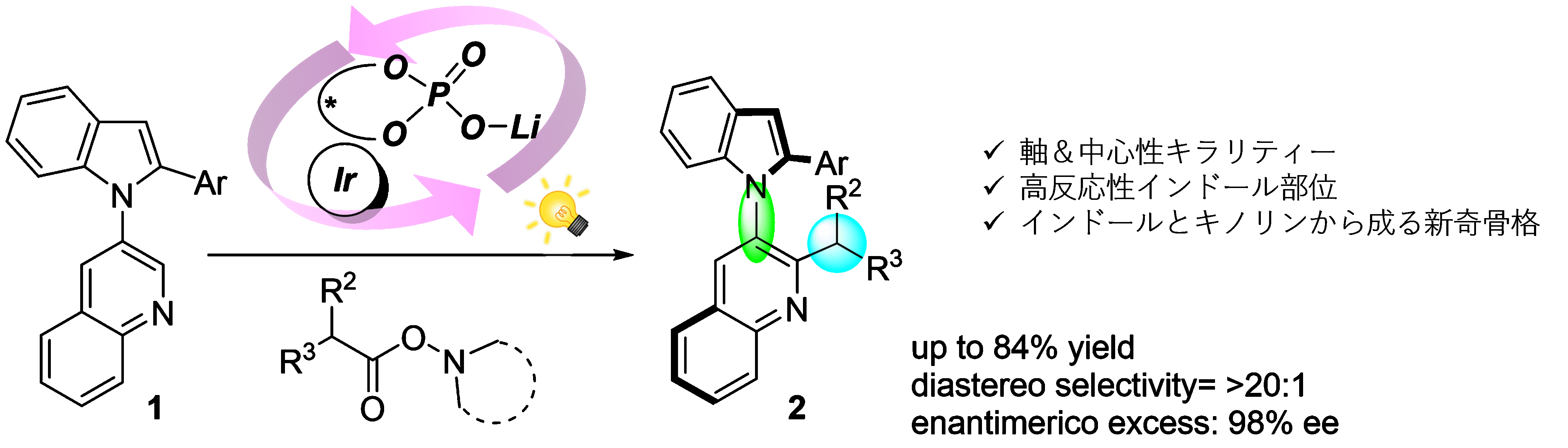
有機化学者は合成が困難なキラル分子の効率的な合成法の開発に古くから取り組んできました。その中で、触媒的不斉合成は少量のキラル触媒によりキラルではない分子から任意のキラル分子を合成することができる強力な手法であると考えられています。では、合成困難な分子とはどんな分子でしょう?様々な要素が考えられますが、今回我々は、1)軸性キラリティーと中心性キラリティーの異なるキラリティー有する、2)反応性の高い部位を有する、3)これまでに合成例のない新奇な骨格を有する、の3つの要素を組み込んだ分子を合成標的としました。本研究ではその触媒的不斉合成の開発及び、合成した新奇骨格分子の三次元的な構造を明らかとしました。
具体的には(N–Indolyl)quinoline(1)を出発物質とし、キラル酸触媒と光酸化還元触媒として働くイリジウムの錯体の協働的な作用により、1の2位に新たな炭素―炭素結合を形成しました。この結合形成段階でキラル触媒が立体を制御することで、生成物(2)が高ジアステレオ選択的かつ高エナンチオ選択的に合成できました。今回我々が見つけた条件下では反応性の高いインドール部位が侵されることなく、高収率で新奇骨格を構築可能でした。新しい分子を合成するとその分子のリアルな姿(絶対立体配置、三次元的な構造)を有機化学者は知りたくなります。本研究では単結晶X線構造解析により、得られた生成物の絶対立体配置の決定にも成功しております。この情報は反応機構の詳細な検討や、生成物の反応性や機能を研究する上では無くてはならないものです。
Enantioselective Synthesis of 3-(N-Indolyl)Quinolines Containing Axial and Central Chiralities
K. Yamanomoto, K. Yamamoto, S. Yoshida, S. Sato, and T. Akiyama
Chem. Commun. 2024, 60, 582-585.
巨大ウイルスの“二次”代謝酵素
巨大ウイルスとは、その名の通り、破格の大きさを持ったウイルスだ。ウイルスは光学顕微鏡では見えないほど小さいことが、かつては常識だった。しかし、巨大ウイルスの発見によりその常識は崩壊した。巨大ウイルスの大きさは、通常のウイルス(0.1 μm以下)の10倍以上に達することもあり、光学顕微鏡で十分に観察することができる。
巨大ウイルスは、ただ巨大なだけでは無い。興味深い性質を数多く有している。その一つが、代謝を行うための酵素を持っていることだ。代謝とは通常、生物が行うもので、多くのウイルスは代謝のための酵素を持たない。
代謝は、一次代謝と二次代謝に分けることができる。一次代謝は、生物の生存に必須の代謝。二次代謝は、必ずしも生物の生存に必須とは言えない代謝である。巨大ウイルスの一次代謝については、既に注目が集まっており、研究が進んでいる。一方、二次代謝は殆どかえりみられず、研究の対象となってこなかった。
そこで今回の研究では、二次代謝の研究に切り込んだ。二次代謝は、生物の生存に必要の無い代謝であるから重要性は低いと思うかもしれないが、そのようなことは全く無い。例えば、自然界からは医薬品のモトとなるような有用物質がしばしば採取されるが、それらの殆どは二次代謝によって生産されるのだ。
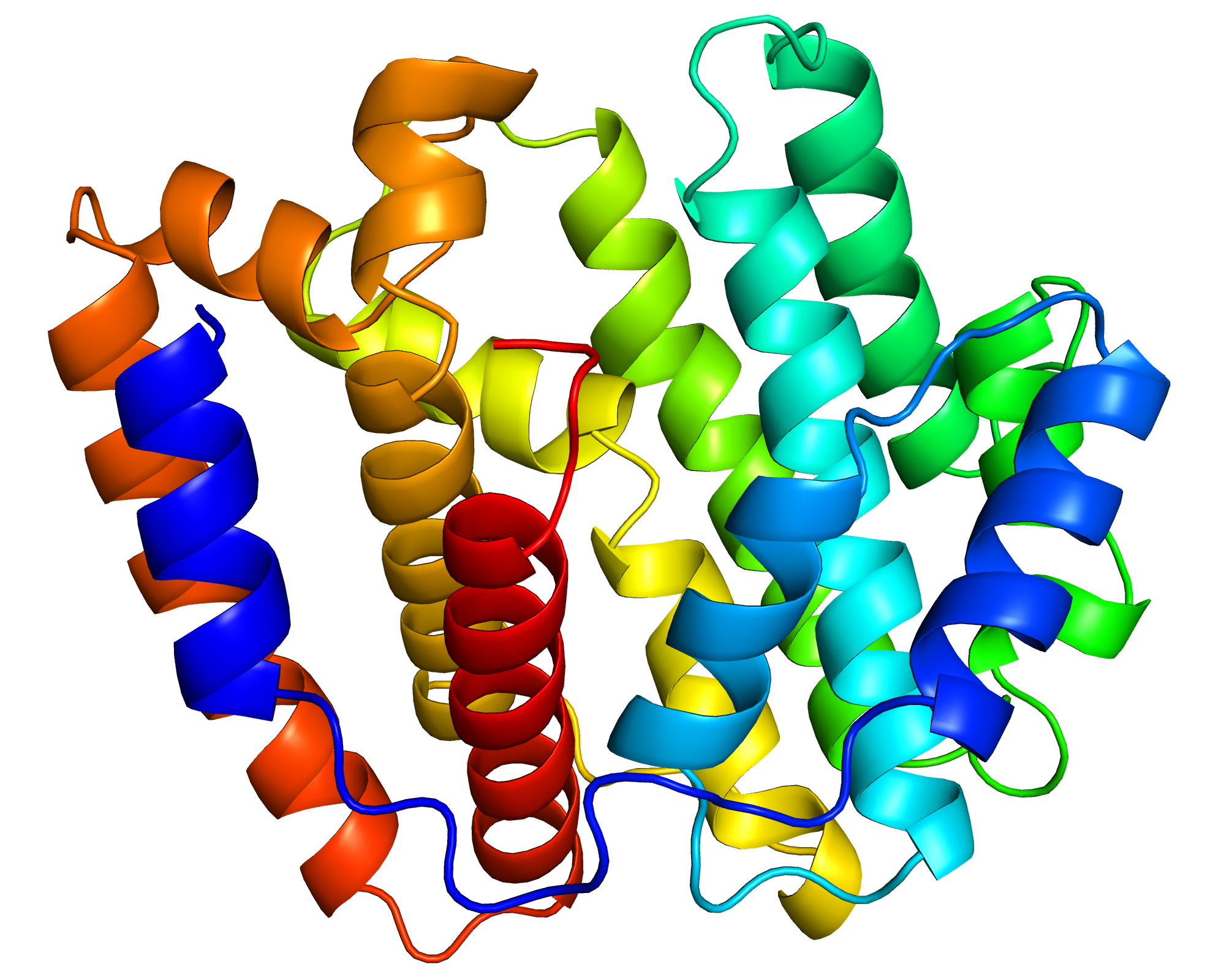
我々は、二次代謝に関わる酵素の中でも特に、テルペン合成酵素と呼ばれる酵素に注目した。この酵素の機能を詳細に調べ、更には、放射光施設を用いた実験によって酵素の構造を明らかにすることにも成功した(上の図はその構造)。本研究は、巨大ウイルスの二次代謝を対象とした研究の幕開けとなる、重要な第一歩であると考えている。
Function and Structure of a Terpene Synthase Encoded in a Giant Virus Genome
Y. Jung, T. Mitsuhashi, S. Sato, M. Senda, T. Senda, and M. Fujita
J. Am. Chem. Soc. 2023, 145, 25966-25970.
植物薬用成分の生合成:60年来の謎に迫る!
――合成化学と超分子化学の融合により不安定中間体の結晶構造解析に成功――
【概要】
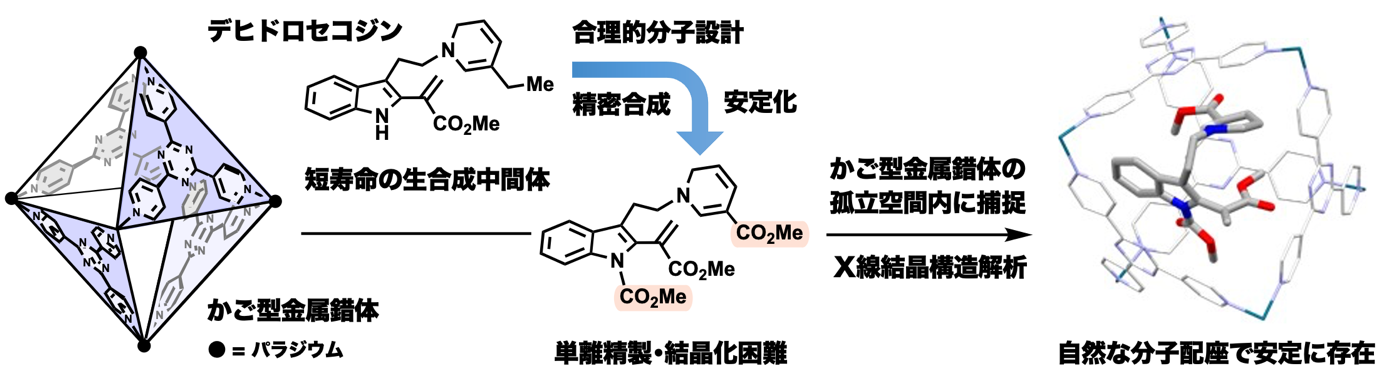
天然物化学(東京大学大学院理学系研究科・大栗博毅教授グループ)と超分子錯体化学(東京大学大学院工学系研究科・藤田誠卓越教授、佐藤宗太特任教授、竹澤浩気助教グループ)を融合したアプローチによる共同研究の成果が原著論文として採択されましたので、その内容を紹介します。今回、薬用資源植物の代謝経路の分岐点に存在する生合成中間体を安定化した分子を設計・合成してかご型金属錯体で包接させ、X線結晶構造解析で立体構造の解明に成功しました。ビンカアルカロイド系抗がん剤の生合成における仮想中間体デヒドロセコジンは、60年以上前に提唱されていましたが、不安定で短寿命のため、その三次元構造は謎のままでした。大栗グループでは、デヒドロセコジンの反応性を最適化する構造変換を施した中間体を設計し、精密に合成しました。安定化を施した合成中間体においても単離精製や結晶化は困難でしたが、藤田グループが開発したかご型金属錯体に包接させると孤立空間内に自然な分子配座で安定に捕捉できることを見出しました。包接錯体のX線結晶構造解析により、薬用植物含有アルカロイドの生合成の鍵中間体であるデヒドロセコジン類の立体構造の解明に成功しました。本研究は、短寿命な中間体を経由する他の生合成プロセスへの適用が期待されるとともに、骨格の多様性を創り出す分子変換に新知見をもたらす成果です。
【詳細】
薬用資源植物は、多様なモノテルペンインドールアルカロイドを生合成します。ビンカアルカロイド系抗がん剤の構成成分となるイボガ型、アスピドスペルマ型の骨格は、多彩な反応性を秘めた共通のデヒドロセコジン型中間体から作り分けられます。生合成経路の分岐点に位置するデヒドロセコジン型の仮想生合成中間体は60年ほど前から提唱されていましたが、非常に不安定で短寿命のため、これまで単離・構造決定した例はなく、その三次元構造は謎に包まれていました。
大栗グループは、デヒドロセコジンを適度に安定化した中間体を設計し、有機合成化学的なアプローチで精密に合成しました。合成化学的に創り出したデヒドロセコジン型の中間体をフラスコ内に発生させることができたものの、依然としてかなり不安定で、単離精製や結晶化は困難でした。藤田グループでは、2013年に自己集合性金属錯体の孤立空間内で有機低分子化合物の構造決定を行う「結晶スポンジ法」を発明しました。本手法によって、一般に結晶化が困難である有機化合物のX線結晶構造解析にブレークスルーがもたらされています。
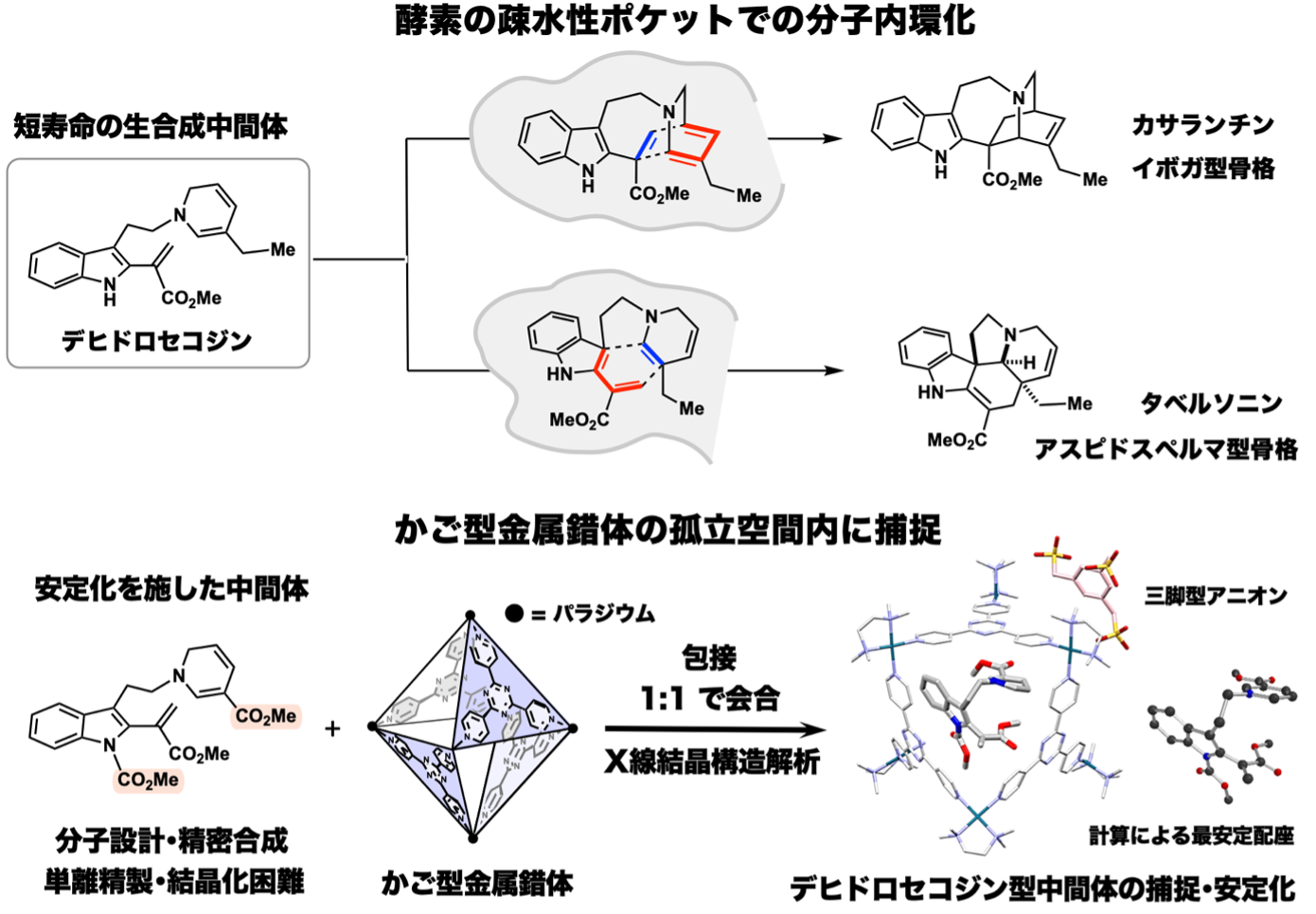
本研究では、藤田グループで開発されたかご型金属錯体の内部孤立空間に大栗グループで合成したデヒドロセコジン型中間体を包接させて安定化し、X線結晶構造解析するアプローチを構想しました。デヒドロセコジン型中間体は、比較的サイズの大きな有機分子なので、亜鉛錯体である結晶スポンジよりも内部空孔が大きいカチオン性のパラジウム錯体を活用しました。正八面体型かご型パラジウム錯体の開口部から不安定なデヒドロセコジン型中間体が内部空孔へ侵入し、1:1のモル比で効率良く包接させるための加熱条件等を検討し、NMR測定により水溶液中での会合体の形成を確認しました。また、カチオン性パラジウム錯体の開口部を三脚型アニオン有機分子で蓋をしながら会合体の結晶化を促進することで、デヒドロセコジン型中間体がかご型金属錯体内に包接された結晶を得ることができました。大型放射光施設SPring-8 BL26B1ビームラインでのX線結晶構造解析により、長年未解明であったデヒドロセコジン型中間体の立体構造を解明することに成功しました。
興味深いことに、今回のX線結晶構造解析で得られたデヒドロセコジン型中間体の三次元構造は、計算で推定した最安定な分子配座とほぼ完全に一致していました。デヒドロセコジン型中間体は、イボガ型およびアスピドスペルマ型骨格を構築する分子内環化反応を起こすために、あらかじめ折り畳まれた分子配座をとっていることが明らかになりました。60年前に提案されたデヒドロセコジンは、様々なテルペンインドールアルカロイドへ分岐する共通の鍵生合成中間体として関与していることを強く支持する結果です。
また、溶液中で不安定で取扱が困難なデヒドロセコジン型中間体をかご型パラジウム錯体で捕捉すると大いに安定化され、長期間にわたり保存が可能となることを見出しました。生合成酵素の疎水性ポケットで発生する短寿命の中間体を中空ホスト錯体の孤立空間で捕捉することで、不安定な中間体の三次元構造を自然な状態で観測しつつ、短寿命の化学種を安定に取り扱うことが可能な先進的な研究プラットフォームを実現することができました。
このように天然物合成化学と超分子錯体化学を発展的に融合するアプローチにより、短寿命の中間体を経由する生合成プロセスの研究の新展開が期待されます。また、多彩な反応性を秘めたデヒドロセコジン型中間体を合理的に安定化しつつ、中空ホスト分子に捕捉する合成化学的アプローチは、骨格の多様性を創り出す分子変換においても今後の進展が大いに期待されます。
Synthetic Modulation of an Unstable Dehydrosecodine-type Intermediate and Its Encapsulation into a Confined Cavity Enable Its X-ray Crystallographic Observation
G. Tay, T. Wayama, H. Takezawa, S. Yoshida, S. Sato, M. Fujita, and H. Oguri
Angew. Chem. Int. Ed. 2023, 62, e202305122.
タンパク質のフォールディングを拡張結晶スポンジ法で解析
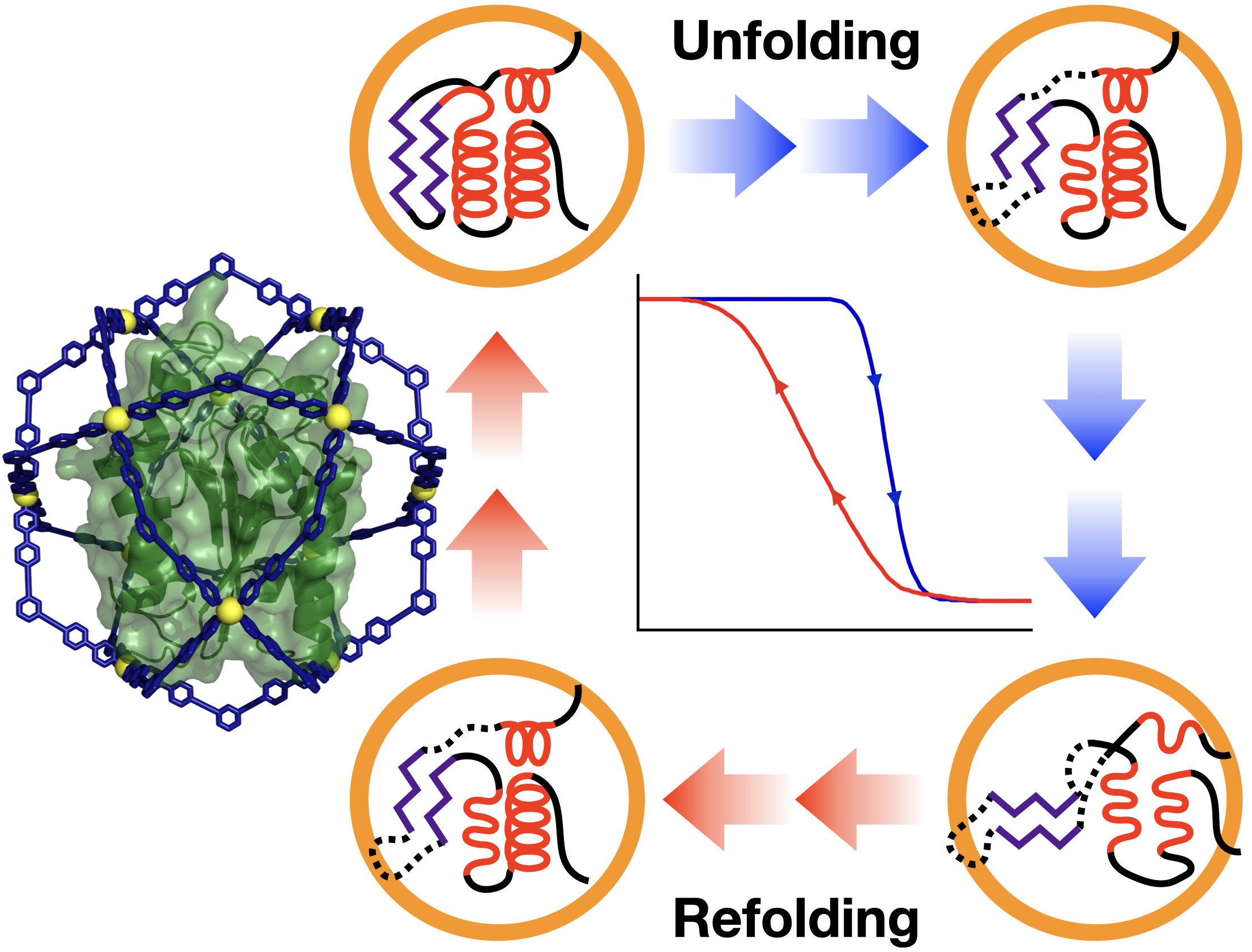
一本のポリペプチド鎖からなるタンパク質が折り畳まれて高次構造をとるフォールディングは、タンパク質の最も基本的な現象でありながら、いまだにその構造解析が十分に達成されていません。これは、フォールディングの過程で生じる構造が不安定で観測が困難であるからです。
我々は、今回この過渡的なフォールディング構造をタンパク質包接法により解析しました。以前報告したタンパク質の中空錯体ケージへの包接(Chem 2021, 7, 2672–2683.)を用いて、タンパク質の高次構造が崩れる(アンフォールディング)、そして巻き戻る(リフォールディング)過程の構造をNMR(核磁気共鳴分光法)で調べました。不安定なアンフォールディング構造は溶液中で凝集し、通常ではその構造を観測することができません。これを錯体ケージの孤立した空間に閉じ込め、その凝集を抑制することで、変性―リフォールディングにおける構造変化を解析することができました。この「空間捕捉」により、有機溶媒と水の混合比を変えていく中でタンパク質のフォールディング構造がどう変わっていくのかを明らかにすることができました。特に興味深かったのは、リフォールディングにおいて変性点よりも低い有機溶媒比率で遅れて巻き戻るヒステリシスを観測したことです。これは、フォールディングの経路が行きと帰りで異なることを示唆しています。こうした構造の知見は錯体ケージへタンパク質を包接したことからこそ見えてきたものです。今後もこのタンパク質包接を、拡張結晶スポンジ法として展開していくことで、タンパク質のさらに面白い新たな構造が解析することができると期待しています。
Hysteresis Behavior in the Unfolding/Refolding Processes of a Protein Trapped in Metallo-Cages
T. Nakama, A. Rossen, R. Ebihara, M. Yagi-Utsumi, D. Fujita, K. kato, S. Sato, and M. Fujita
Chem. Sci. 2023, 14, 2910–2914.
結晶スポンジ法がビールを美味しくする!?

世界中で愛飲されているビール。爽快な苦味が癖になる、そんな人も多いのではないでしょうか。しかし、意外なことにビールに含まれる苦味成分については科学的にまだまだ明らかになっていないことが沢山あるのです。原料であるホップに含まれるα酸という化合物がビールの苦味の起源となる化合物であり、醸造工程でα酸はイソα酸に異性化します。このα酸、およびイソα酸の”正しい構造”が解明されたのは、なんと2013年になってからなのです。天然物の構造解析が難しいことを物語っている例ともいえます。α酸やイソα酸はさらに様々な成分に化学変化することが知られているのですが、その構造を特定した例は極僅かであり、ビール中には未だ化学的に明らかにされていない苦味成分が多数含まれています。我々はHPLCと結晶スポンジ法を効果的に組み合わせることで、微量の未知苦味成分を網羅的に解明することに世界で初めて成功しました。今回解明したイソα酸が変化して出来る化合物は、いずれも複雑な立体構造を有しており結晶スポンジ法が威力を発揮しました。変化物の構造を解明したことで、化学変化が起こるメカニズムが理解できるようになります。このような知見は反応をコントロールして鮮度を維持したり、苦味成分組成をコントロールして味を調節したり、新たな醸造技術の開発に繋がります。結晶スポンジ法の産業利用という面でも重要な成果と考えています。
Comprehensive Structural Analysis of the Bitter Components in Beer by the HPLC-Assisted Crystalline Sponge Method
Y. Taniguchi, T. Kikuchi, S. Sato, and M. Fujita
Chem. Eur. J. 2021, 28, e202103339.
拡張スポンジ法−包接によるタンパク質の構造解析を目指して−

本研究では、巨大な中空構造をもつ錯体分子に天然タンパク質を精密に内包し、包接されたタンパク質の構造・性質を初めて詳細に解析しました。その結果、タンパク質が錯体内の空間に閉じ込められることで安定化し、さらに壊れかけたタンパク質の3次元構造が修復されるリフォールディングが起きることを見出しました。これらの「空間捕捉効果」を活用することで観測困難であったタンパク質の構造を解明する手法を今後開発していきます。
「タンパク質は狭い空間に閉じ込めるとその振る舞いが変わるのか?」自己組織化の研究で生じた素朴な疑問に答えるために、中空空間をもつ人工分子にタンパク質を包接する検討を10年来試みてきました。タンパク質(分子量は1万以上)は、有機小分子(分子量は500以下)よりも遥かに大きく、さらにタンパク質の複雑な立体構造を保ったまま中空錯体分子へ包接することは困難を極めました。タンパク質を包接できるほど大きな内部空間をもつ世界最大の錯体分子の構築には成功していたものの、当初はわざわざタンパク質の一部に改変を加えて錯体内に入れ、包接できたことを確認するだけで精一杯でした(Nat. Commun. 2012, 3, 1093. 10.1038/ncomms2093)。
今回Chem誌に発表した研究では、新しい包接手法を開発することで、改変操作を省き、天然型のタンパク質を中空錯体分子に包接することを達成しました。タンパク質のN末端アミノ基との選択的な縮合反応を活用することで、天然構造を保ったままタンパク質を中空錯体分子内に包接することができました。さらに、包接したタンパク質の構造と合わせて、その酵素活性を初めて評価し、狭い空間内でのタンパク質が示す機能を世界に先駆けて明らかにしました。本研究の包接手法は、タンパク質に共通するN末端を活用するため、ほぼ全ての天然タンパク質に適用することができます。
クチナーゼ様酵素(CLE)というタンパク質を包接し、その機能と構造を解析すると驚くほどの安定化効果が観測されました。例えば、CLEはアセトニトリル溶媒中では1時間以内に完全に失活して酵素機能が無くなってしまいますが、狭い空間内に包接することで1ヶ月後でも酵素機能を保持していました(1,000倍以上の安定化効果)。これは、アセトニトリル溶媒中という変性条件ではタンパク質が立体的な高次構造を失って凝集してしまうのに対し、包接されたタンパク質は空間的に隔離され変性・凝集が抑制されたからだと分かりました。さらに、包接CLEはアセトニトリル溶媒中で2週間後には構造が崩れ始めていたものの、溶媒を水に替えることで高次構造が復元し、酵素活性が完全に再生しました。この分子シャペロンを想起させるリフォールディング効果は、狭い空間にタンパク質を1分子だけ包接できたからこそ生じたものです。このように、タンパク質に「空間捕捉効果」がはたらき、狭い空間内で特異な性質が発現することが明らかになりました。
我々は、このタンパク質を包接する化学を「拡張スポンジ法」と名付け、高度なタンパク質の構造解析技術へと発展させることを目指して研究しています。構造が厳密に定まった中空錯体分子の内部空間は、タンパク質の詳細な構造情報を得るのに適した場を与えます。さらに、「空間捕捉効果」を活用することで誰も観測し得なかったタンパク質の構造を捉えることができると考えています。例えば、中空錯体内部に不安定なタンパク質や中間体状態での構造を捕捉することで、これまで観測困難であったタンパク質の動的・過渡的な構造を解明できるでしょう。将来的には、タンパク質の構造解析の全く新しいアプローチとして、ライフサイエンス全般に革新をもたらすような技術へと発展させることを思い描いています。
Protein stabilization and refolding in a gigantic self-assembled cage
D. Fujita, R. Suzuki, Y. Fujii, M. Yamada, T. Nakama, A. Matsugami, F. Hayashi, J.-K. Weng, M. Yagi-Utsumi, and M. Fujita
Chem 2021, 7, 2672–2683.
結晶スポンジ法:その原理と概念実証研究
本総説では、我々にとってのコア技術である結晶スポンジ法が生まれるまでに至った歴史的背景、およびその原理について解説しています。加えて、結晶スポンジ法の開発以降に我々や国内外の研究者たちが見出した技術的な改良点、および結晶スポンジ法の効果的な応用研究例についても触れています。
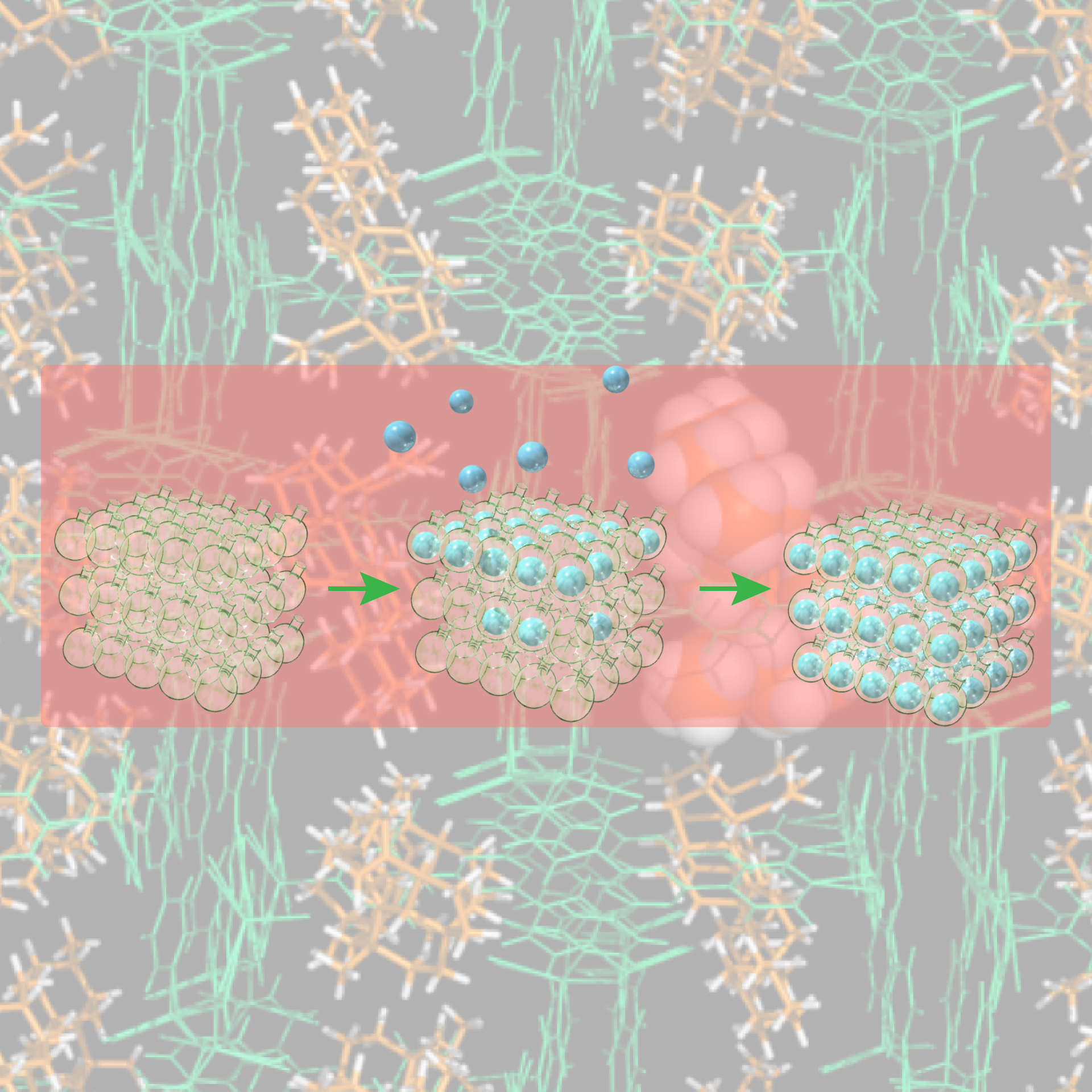
Crystalline Sponge Method: X-ray Structure Analysis of Small Molecules by Post-Orientation within Porous Crystals—Principle and Proof-of-Concept Studies
N. Zigon, V. Duplan, N. Wada, and M. Fujita
Angew. Chem. Int. Ed. 2021, 60, 25204-25222.